Im Gegensatz zur Gastrointestinalchirurgie sind die Folgen einer Brustkrebsoperation, insbesondere durch den Siegeszug brusterhaltender Operationstechniken, deutlich weniger drastisch. Dennoch berichten 20 bis 50% aller Frauen, die sich einer Brustoperation unterzogen, von einer Chronifizierung des post-operativen Schmerzes10-11-12, welche auch nach 9 Jahren noch berichtet wird13. In einem vermutlich reziproken Verhältnis zu den Schmerzen steht auch die funktionelle Einschränkung des Schultergelenks. So geben etwa 1/3 der Patientinnen 3 Jahre post-op an, unter verminderter Schulterbeweglichkeit zu leiden. Etwa die Hälfte der Frauen nach Brustkrebsoperation geben an, Einschränkungen in ihren Alltagsaktivitäten zu verspüren. Diese sind in den meisten Fällen allerdings nur von geringem Ausmaß und lediglich im einstelligen Prozentsatz als schwerwiegend einzustufen14-15.
Fitness, Training und Operationsergebnis
Aus Beobachtungs- und Querschnittsstudien ist bekannt, dass Patienten die mit einer höheren Fitness in eine Operation gehen, mit weniger post-operativen Symptomen zu kämpfen haben, weniger Komplikationen aufweisen und kürzere Krankenhausaufenthalte aufzeigen. Beispielsweise identifizierten Snowden und Kollegen in einem Kollektiv von Personen mit einem mittleren Alter von 66 Jahren die anaerobe Schwelle der Patienten als wichtigsten Prädiktor der postoperativen Versterbewahrscheinlichkeit16. Die Ausdauerleistungsfähigkeit eliminierte sogar den Einfluss des Alters, wonach Patienten höheren Alters genau so viele Krankenhaustage und Zeit auf der Intensivstation verbrachten, wie jüngere Patienten mit vergleichbarer kardiorespiratorischer Fitness. Aber auch der Muskelmasse kann eine bedeutende Rolle in der Vorhersage von postoperativen Komplikationen nachgesagt werden17. Dies sind bereits gute Indikatoren dafür, eine strukturierte Bewegungsintervention zur Verbesserung der konditionellen Fähigkeiten einer Operation voranzustellen. Inwiefern derartige prähabilitative Bewegungsprogramme effektiv sind, dazu liegt bereits eine vielversprechende, verschiedene Operationen übergreifende, Datenlage vor. In einer systematischen Übersichtsarbeit mit insgesamt 435 Patienten die sich verschiedenen intraabdominalen Operationen unterzogen hatten (colorektal-, abdominal, oberer GI-Trakt, bariatirische OP und Hepaktomie), konnte eine signifikante Reduktion der postoperativen Komplikationen in den Bewegungsgruppen beobachtet werden18. In einem RCT mit 125 hoch-Risiko Patienten (Amercian Society of Anesthesiologists score III/IV) die sich einer größeren abdominalen Operation unterzogen, zeigte sich eine Risikoreduktion von postoperativen Komplikationen von 50% durch ein bewegungstehrapeutisches Programm, verglichen mit der standard-care Kontrollgruppe19. Besonders effektiv scheint Bewegung in der Reduktion von Komplikationen zu wirken, bei welchen das pulmonale System betroffen ist. Beispielsweise konnten Hulzebos et al. in einem randomisiert-kontrollierten Studie mit insgesamt 276 Patienten eine Risikoreduktion von 60% beobachten (KI= 0.19, 0.86) und verkürzter Krankenhausaufenthalt20. Hier führten die Patienten allerdings lediglich ein Training der Atemmuskulatur durch. Konsistent konnte in Studien zur Operation von Patienten, die unter gastrointestinalen Tumoren leiden, eine Verkürzung der Hospitalisieren beobachtet werden21-22-23-24-25. Selbes gilt auch für Patienten die sich einer Bypass Operation der Koronararterien unterzogen26-27. Hierbei scheinen die kardiorespiratorsiche Fitness ebenso wie die Muskelkraft wichtige und altersunabhängiger Faktoren darzustellen16-28-29. Trotz der lediglich kurzen Interventionsdauer konnten auch statistisch signifikante Verbesserungen der konditionellen Leistungsfähigkeit beobachtet werden (25-GI)30. Eine detailierte Darstellung der Studien findet sich in der angehängten Tabelle 1.
Wirkmodell
Der Wirksamkeit von prähabilitiven Trainings liegt die Modellvorstellung, wie in Abb.1. dargestellt, zu Grunde, dass die Steigerung der Gesundheitsressourcen, wie der Fitness, vor einer Operation mit einem besseren unmittelbaren postoperativen Zustand einhergeht, von welchem aus die Rehabilitation, in diesem Sinne die Rückkehr zum Status vor der präoperativen Intervention, kürzer ausfällt. Durch die mannigfaltigen positiven Wirkungen, welche mit einer verbesserten Fitness einhergehen, stellt Bewegung ein wunderbares Instrument für den prähabilitativen Einsatz dar. Insbesondere da auch davon ausgegangen werden kann, dass weitere relevante Parameter, welche mit dem Erfolg einer Operation assoziiert sind, wie beispielsweise die Wundheilung31-32-33, deutlich von einer Bewegungsintervention profitieren. Zentral ist hierbei die antiiflamatorische und immunologische Wirkung von Bewegung34-35.
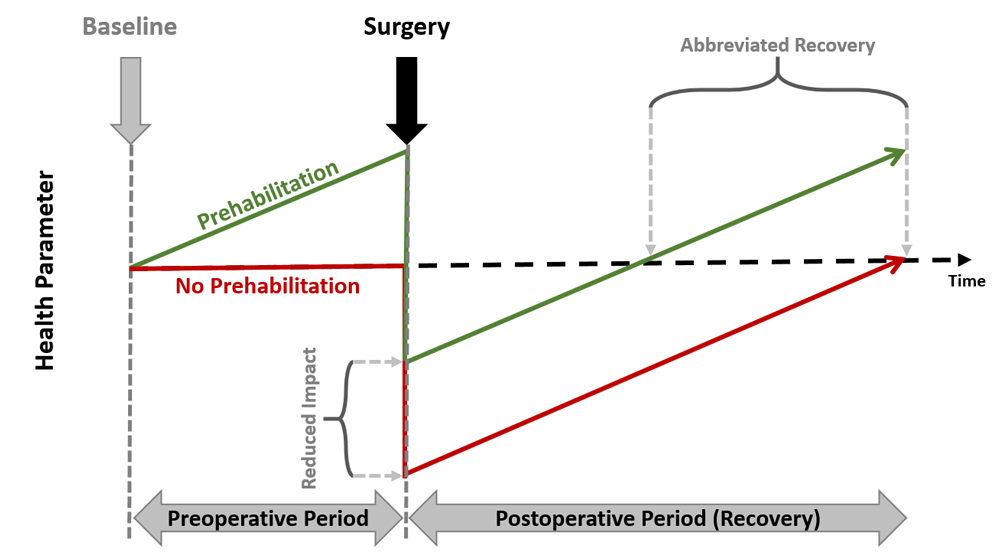 Abbildung 1. Prehabilitation model (Modifiziert nach Carli et al., 2017)36
Abbildung 1. Prehabilitation model (Modifiziert nach Carli et al., 2017)36
Abbildung 1. Prehabilitation model (Modifiziert nach Carli et al., 2017)36
Fazit für Praxis und Forschung
Es ist wichtig, nicht nur die Wirksamkeit von Bewegung im Generellen auf die postoperativen Outcomes zu untersuchen, sondern bereits im Entwurf der Studien Trainingsinterventionen so zu planen, dass sie die gewünschten Outcomes bestmöglich adressieren. Hier geht es z. B. darum ein spezifisches Ziel zu verfolgen, wie es beispielsweise eine zielgerichtete Kräftigung der lokalen, gelenkstabilisierenden Muskulatur vor einem orthopädischen Eingriff unter Gesichtspunkten der schnellstmöglichen neuromuskulären Kraftsteigerung tut oder wie es durch eine Verbesserung der präoperativen Beweglichkeit durch exzentrische Muskelarbeit geschieht. Den kurzen Interventionszeitraum berücksichtigend, müssen prähabilitative Intervention besonders effizient sein. Dies muss bereits in der Therapieplanung berücksichtigt werden, weswegen hier die in der Literatur stiefmütterlich behandelte Evidenzbasierung der konkreten Interventionen besondere Bedeutung geschenkt werden muss37, wie in Abb.2 als Entscheidungsbaum dargestellt.
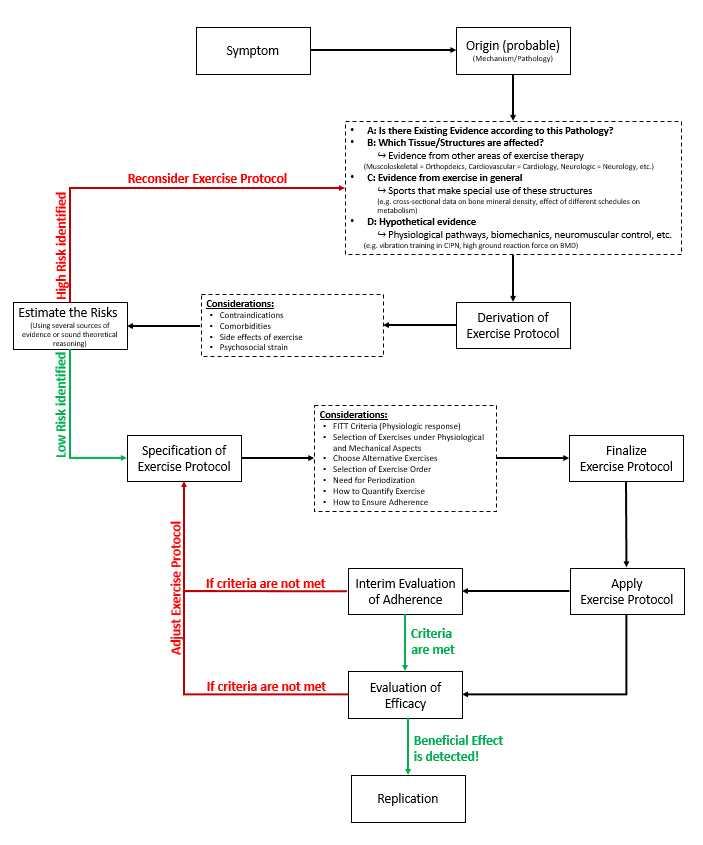 Abbildung 2. Entscheidungsbaum – Evidenzbasierte Bewegungsprogramme
Abbildung 2. Entscheidungsbaum – Evidenzbasierte Bewegungsprogramme
Abbildung 2. Entscheidungsbaum – Evidenzbasierte Bewegungsprogramme
![]() Tab.1. Tabelle 1 Summary of Studies
Tab.1. Tabelle 1 Summary of Studies
Literatur
- Haberland J, Wolf U. Trendanalysen zur Inzidenz und Mortalität an Krebs in Deutschland seit 1970. 2015
- Nurgali K, Jagoe RT, Abalo R. Adverse Effects of Cancer Chemotherapy: Anything New to Improve Tolerance and Reduce Sequelae? Frontiers in pharmacology 2018;9:245.
- Kim H-H, Hyung WJ, Cho GS, et al. Morbidity and mortality of laparoscopic gastrectomy versus open gastrectomy for gastric cancer: an interim report—a phase III multicenter, prospective, randomized Trial (KLASS Trial). Annals of surgery 2010;251(3):417-20.
- Spanjersberg W, Van Sambeeck J, Bremers A, et al. Systematic review and meta-analysis for laparoscopic versus open colon surgery with or without an ERAS programme. Surgical endoscopy 2015;29(12):3443-53.
- Sano T, Sasako M, Yamamoto S, et al. Gastric cancer surgery: morbidity and mortality results from a prospective randomized controlled trial comparing D2 and extended para-aortic lymphadenectomy-Japan Clinical Oncology Group study 9501. Journal of clinical oncology 2004;22(14):2767-73.
- Yasunaga H, Horiguchi H, Kuwabara K, et al. Outcomes after laparoscopic or open distal gastrectomy for early-stage gastric cancer: a propensity-matched analysis. Annals of surgery 2013;257(4):640-46.
- Kneuertz PJ, Pitt HA, Bilimoria KY, et al. Risk of morbidity and mortality following hepato-pancreato-biliary surgery. Journal of Gastrointestinal Surgery 2012;16(9):1727-35.
- Hendren S, Birkmeyer JD, Yin H, et al. Surgical complications are associated with omission of chemotherapy for stage III colorectal cancer. Diseases of the Colon & Rectum 2010;53(12):1587-93.
- Tahiri M, Sikder T, Maimon G, et al. The impact of postoperative complications on the recovery of elderly surgical patients. Surgical Endoscopy 2016;30:1762-70.
- Cregg R, Anwar S, Farquhar-Smith P. Persistent postsurgical pain. Current opinion in supportive and palliative care 2013;7(2):144-52.
- Gärtner R, Jensen M-B, Nielsen J, et al. Prevalence of and factors associated with persistent pain following breast cancer surgery. Jama 2009;302(18):1985-92.
- Kehlet H, Jensen TS, Woolf CJ. Persistent postsurgical pain: risk factors and prevention. The Lancet 2006;367(9522):1618-25.
- Macdonald L, Bruce J, Scott NW, et al. Long-term follow-up of breast cancer survivors with post-mastectomy pain syndrome. British journal of cancer 2005;92(2):225.
- Devoogdt N, Van Kampen M, Christiaens M, et al. Short‐and long‐term recovery of upper limb function after axillary lymph node dissection. European journal of cancer care 2011;20(1):77-86.
- Khan F, Amatya B, Pallant JF, et al. Factors associated with long-term functional outcomes and psychological sequelae in women after breast cancer. The Breast 2012;21(3):314-20.
- Snowden CP, Prentis J, Jacques B, et al. Cardiorespiratory fitness predicts mortality and hospital length of stay after major elective surgery in older people. Annals of surgery 2013;257(6):999-1004.
- Huang DD, Wang SL, Zhuang CL, et al. Sarcopenia, as defined by low muscle mass, strength and physical performance, predicts complications after surgery for colorectal cancer. Colorectal Disease 2015;17(11):O256-O64.
- Moran J, Guinan E, McCormick P, et al. The ability of prehabilitation to influence postoperative outcome after intra-abdominal operation: a systematic review and meta-analysis. Surgery 2016;160(5):1189-201.
- Barberan-Garcia A, Ubré M, Roca J, et al. Personalised prehabilitation in high-risk patients undergoing elective major abdominal surgery: a randomized blinded controlled trial. Annals of surgery 2018;267(1):50-56.
- Hulzebos EH, Helders PJ, FaviÚ NJ, et al. Preoperative intensive inspiratory muscle training to prevent postoperative pulmonary complications in high-risk patients undergoing CABG surgery: a randomized clinical trial. Jama 2006;296(15):1851-57.
- Kaibori M, Ishizaki M, Matsui K, et al. Perioperative exercise for chronic liver injury patients with hepatocellular carcinoma undergoing hepatectomy. The American Journal of Surgery 2013;206(2):202-09.
- Cho H, Yoshikawa T, Oba MS, et al. Matched pair analysis to examine the effects of a planned preoperative exercise program in early gastric cancer patients with metabolic syndrome to reduce operative risk: the Adjuvant Exercise for General Elective Surgery (AEGES) study group. Annals of surgical oncology 2014;21(6):2044-50.
- Dronkers JJ, Lamberts H, Reutelingsperger I, et al. Preoperative therapeutic programme for elderly patients scheduled for elective abdominal oncological surgery: a randomized controlled pilot study. Clinical rehabilitation 2010;24(7):614-22.
- Barbalho-Moulim MC, Miguel GPS, Forti EMP, et al. Effects of preoperative inspiratory muscle training in obese women undergoing open bariatric surgery: respiratory muscle strength, lung volumes, and diaphragmatic excursion. Clinics 2011;66(10):1721-27.
- Santa Mina D, Clarke H, Ritvo P, et al. Effect of total-body prehabilitation on postoperative outcomes: a systematic review and meta-analysis. Physiotherapy 2014;100(3):196-207.
- Herdy AH, Marcchi PL, Vila A, et al. Pre-and postoperative cardiopulmonary rehabilitation in hospitalized patients undergoing coronary artery bypass surgery: a randomized controlled trial. American journal of physical medicine & rehabilitation 2008;87(9):714-19.
- Arthur HM, Daniels C, McKelvie R, et al. Effect of a preoperative intervention on preoperative and postoperative outcomes in low-risk patients awaiting elective coronary artery bypass graft surgery: a randomized, controlled trial. Annals of internal medicine 2000;133(4):253-62.
- Mendes J, Azevedo A, Amaral TF. Handgrip strength at admission and time to discharge in medical and surgical inpatients. Journal of Parenteral and Enteral Nutrition 2014;38(4):481-88.
- Dronkers JJ, Chorus AMJ, Van Meeteren NLU, et al. The association of pre-operative physical fitness and physical activity with outcome after scheduled major abdominal surgery. Anaesthesia 2013;68:7 S.
- Vermillion SA, James A, Dorrell RD, et al. Preoperative exercise therapy for gastrointestinal cancer patients: a systematic review. Systematic reviews 2018;7(1):103.
- Emery CF, Kiecolt-Glaser JK, Glaser R, et al. Exercise accelerates wound healing among healthy older adults: a preliminary investigation. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences 2005;60(11):1432-36.
- O'brien J, Finlayson K, Kerr G, et al. Evaluating the effectiveness of a self‐management exercise intervention on wound healing, functional ability and health‐related quality of life outcomes in adults with venous leg ulcers: a randomised controlled trial. International wound journal 2017;14(1):130-37.
- Keylock KT, Vieira VJ, Wallig MA, et al. Exercise accelerates cutaneous wound healing and decreases wound inflammation in aged mice. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology 2008;294(1):R179-R84.
- Goh J, Ladiges WC. Exercise enhances wound healing and prevents cancer progression during aging by targeting macrophage polarity. Mechanisms of ageing and development 2014;139:41-48.
- Fiuza-Luces C, Garatachea N, Berger NA, et al. Exercise is the real polypill. Physiology 2013;28(5):330-58.
- Carli F, Gillis C, Scheede-Bergdahl C. Promoting a culture of prehabilitation for the surgical cancer patient. Acta Oncologica 2017;56(2):128-33.
- Hamacher D, Köppel M. Ausgewählte Aspekte der angewandten Biomechanik als Grundlage für das Kräftigungstraining an Geräten. B&G Bewegungstherapie und Gesundheitssport 2018;34(01):32-38.





